Iec 62366 - Iec Tr 62366 2 2016 Gebrauchsanleitung Fur Die Iec 62366 1 2015
Application of usability engineering to medical devices IEC TR 62366-22016. Die neue IEC 62366 besteht aus zwei Teilen der Norm selbst IEC 62366-1 und einem informativen Technical Report IEC 62366-2.
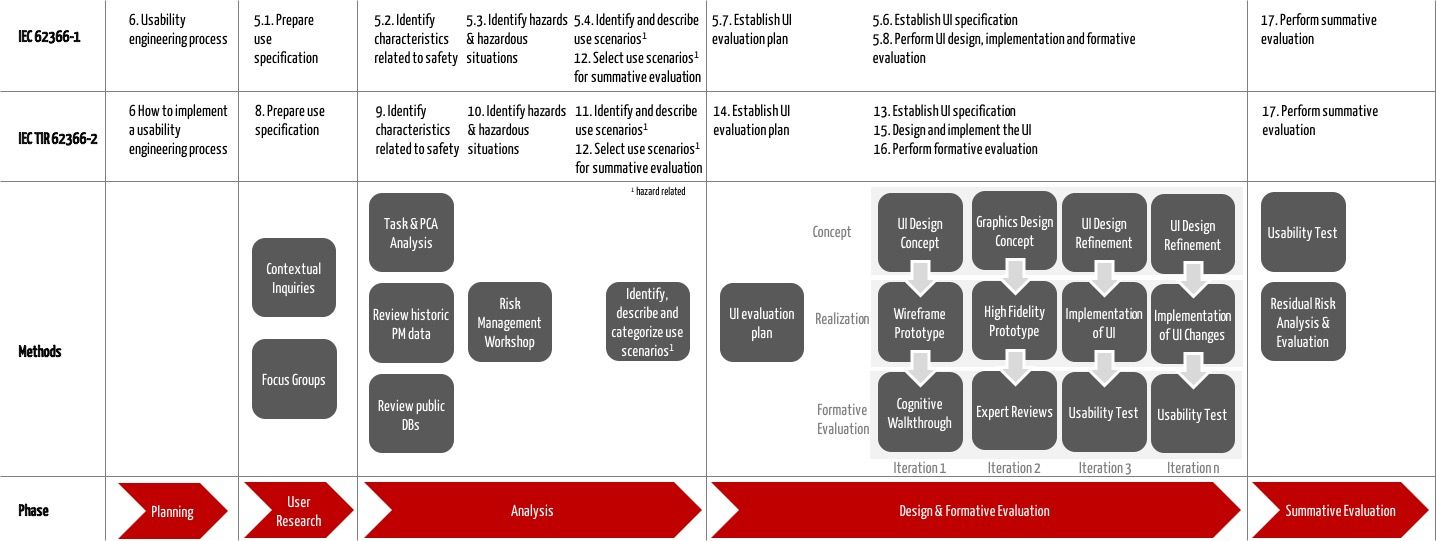
Iec Tr 62366 2 2016 Gebrauchsanleitung Fur Die Iec 62366 1 2015
3 Jahre nach dem Datum der Veröffentlichung soll eine Umsetzung auf nationaler Ebene erlassen werden.

Iec 62366. IEC 62366-12015 specifies a PROCESS for a MANUFACTURER to analyse specify develop and evaluate the USABILITY of a MEDICAL DEVICE as it relates to SAFETY. Sie gilt nicht für klinische Entscheidungen die sich auf die Verwendung des Geräts beziehen können. Die Nachfolgenorm IEC 62366-1 wird diese Vereinfachung ebenfalls beinhalten.
In diesem Seminar lernen Sie die Anforderungen der. Zuständig ist das DKEUK 8114 Ergonomie Gebrauchstauglichkeit Gebrauchsanweisung der DKE Deutsche Kommission Elektrotechnik Elektronik Informationstechnik in DIN und VDE. In die IEC 62366-1 die den Prozess beschreibt und die IEC 62366-2 die Erläuterungen für den Gebrauchstauglichkeitsprozess liefert.
Die erste Ausgabe von IEC 62366-1 wurde in 2015 veröffentlicht. IEC 623662007 Medical devices Application of usability engineering to medical devices. IEC 62366-12015 Part 1.
IEC 62366 ist eine prozessbasierte Norm die Herstellern von Medizinprodukten helfen soll ein Design für hohe Benutzerfreundlichkeit zu entwickeln. Jedoch stellt die EN 62366-1 für viele Anforderungen den Stand der Technik dar. This standard has been revised by IEC 62366-12015.
Ausgabe wird die IEC 62366-Serie in zwei Dokumente aufgespaltet. Betrifft alle Medizinprodukte und IVD In-vitro Diagnostik Hersteller die Medizinprodukte undoder IVD entwickeln. This first edition of IEC 62366-1 together with the first edition of IEC 62366-2 not published yet cancels and replaces the first edition of IEC 62366 published in 2007 and its Amendment 12014.
Ausgabe der IEC 62366. Part 1 has been updated to include contemporary concepts of usability engineering while also streamlining the process. IEC 62366-12015 specifies a process for a manufacturer to analyse specify develop and evaluate the usability of a medical device as it relates to safety.
Seit ihrer Veröffentlichung haben Experten die in diesem Bereich arbeiten mehrere Ungenauigkeiten identifiziert die. Alle diese regulatorischen Anforderungen fordern Usability Engineering im Entwicklungsprozess von Medizinprodukten. Guidance on the application of usability engineering to medical devices To be more usable easier to understand than original 62366 Contains the what requirements in Part 1 the how is in 62366-2 Closer ties to risk management EN ISO 14971.
In die IEC 62366-1 die den Prozess beschreibt und die IEC 62366-2 die Erläuterungen für den Gebrauchstauglichkeitsprozess liefert. This usability engineering human factors engineering process permits the manufacturer to assess and mitigate risks associated with correct use and use errors ie normal use. Specifies a process for a manufacturer to analyse specify design verify and validate usability as it relates to safety of a medical device.
This USABILITY ENGINEERING HUMAN FACTORS ENGINEERING PROCESS permits the MANUFACTURER to assess and mitigate RISKS associated with CORRECT USE and USE ERRORS ie NORMAL USE. Die IEC 62366-1 ist seit Juni 2020 veröffentlicht. 14 Betrifft Sie wenn.
This usability engineering process assesses and mitigates risks caused by usability problems. Ausgabe der IEC 62366. Anforderungen der IEC 62366-12015 an die Prüfung der Gebrauchstauglichkeit.
Auf diese Weise ließ sich der normative Teil entschlacken. Ausgabe wird die IEC 62366-Serie in zwei Dokumente aufgespaltet.

Iec Tr 62366 2 2016 Iec Normen Vde Verlag

Iec 62366 1 2015 Iec Normen Vde Verlag
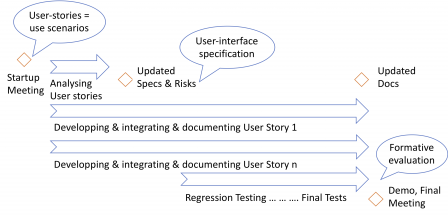
Iec 62366 1 And Usability Engineering For Software Software In Medical Devices By Md101 Consulting

Gebrauchstauglichkeitsakte Kompetent Und Schnell Erstellen

Design For Risk Control The Role Of Usability Engineering In The Management Of Use Related Risks Sciencedirect
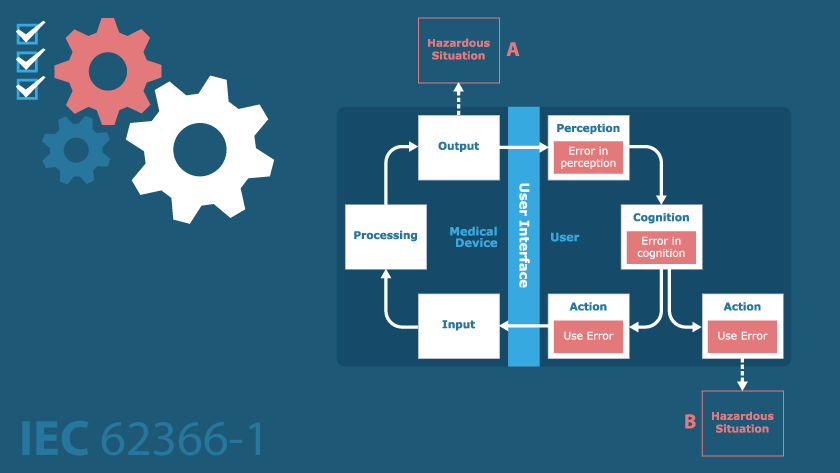
Anforderungen An Die Gebrauchstauglichkeit Von Medizinprodukten Nach Iec 62366 1

Usability Engineering Process C Iec 62366 2007 Fig D 1 27 Download Scientific Diagram

Din En 62366 1 Vde 0750 241 1 2017 07 Standards Vde Publishing House
Https Cdn Standards Iteh Ai Samples 100370 B396398e7f50469bb54189c426ed842b Iec 62366 1 2015 Amd1 2020 Pdf

Design For Risk Control The Role Of Usability Engineering In The Management Of Use Related Risks Sciencedirect
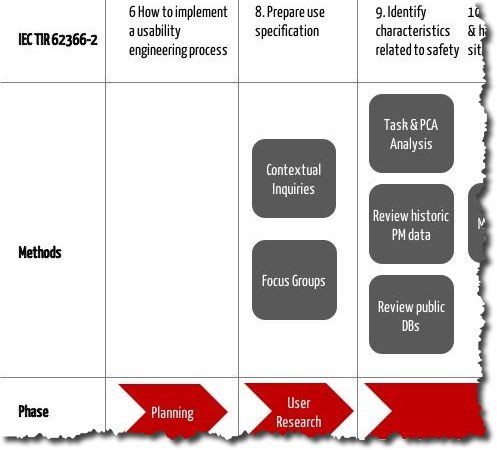
Iec Tr 62366 2 2016 Gebrauchsanleitung Fur Die Iec 62366 1 2015
Iec60601 Iec62304 Iec 62366 Pcba Design Prototype Dh Regsys Pte Ltd

Medical Device Usability Highlights Of European Regulations And The Latest Standards Youtube
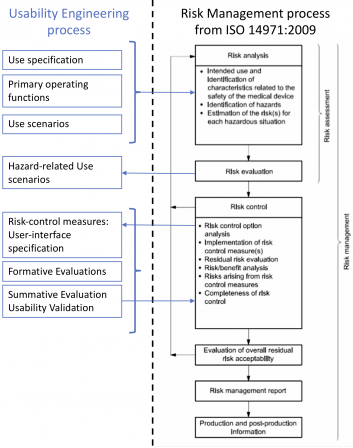
Iec 62366 1 And Usability Engineering For Software Software In Medical Devices By Md101 Consulting

Iec 62366 Developing Product Usability And Creating Opportunities For Competitive Advantage Sgs
Https Www Qservegroup Com Eu De I809 Amendment 1 2020 06 To The Iec 62366 1 Standard For Usability Engineering Published
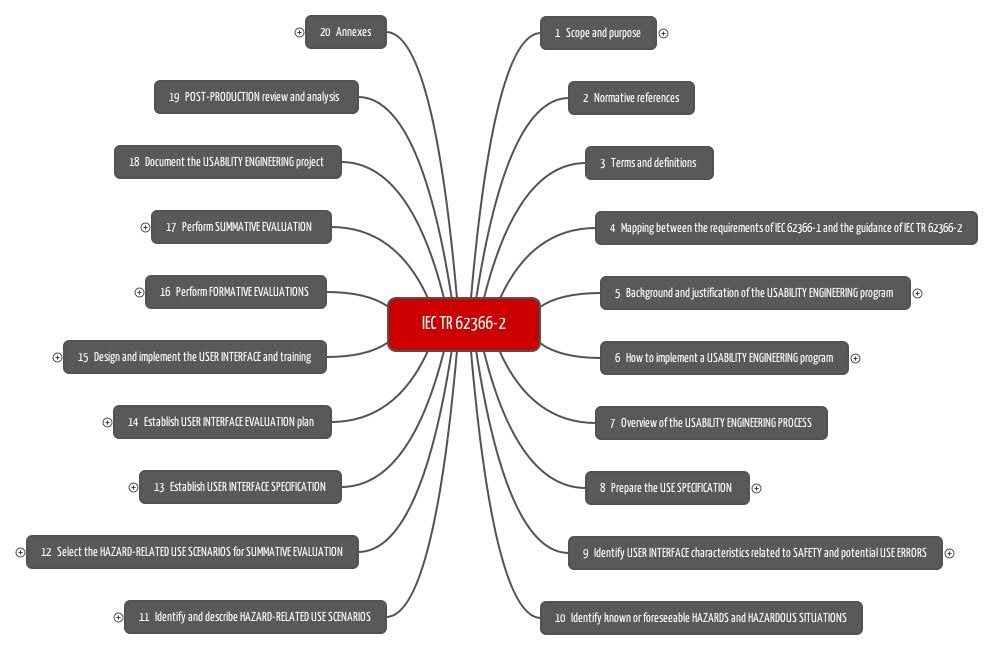
Iec Tr 62366 2 2016 Gebrauchsanleitung Fur Die Iec 62366 1 2015

Iec 62366 Gebrauchstauglichkeit Medizinprodukte Iec 62366 1 2015

